칼슘(Ca)의 밀도 계산. 입방 최조밀 쌓임 구조 fcc 원자 반지름 197 pm
고체 칼슘은 입방 최조밀 쌓임 구조를 가지고 있다.
칼슘의 원자 반지름을 197 pm라고 가정하고,
고체 칼슘의 밀도를 계산하라.
단, Ca의 몰질량 = 40.08 g/mol
Calcium has a cubic closest packed structure as a solid.
Assuming that calcium has an atomic radius of 197 pm,
calculate the density of solid calcium.
---------------------------------------------------
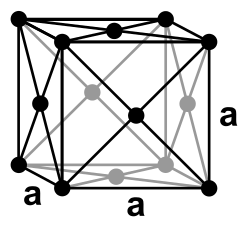
A cubic closest packed structure contains a fcc unit cell.
---> 단위세포에 있는 원자의 개수 = 4개 (4 atoms)
( 참고 https://ywpop.tistory.com/12440 )
[ 그림 출처 Wikimedia ] face-centered cubic unit cell.
단위세포의 질량, mass of unit cell
= (4 atoms) (40.08 g/mol) (1 mol / 6.022×10^23 atoms)
= (4) (40.08) (1 / (6.022×10^23))
= 2.66224×10^(-22) g
a = 4r / sqrt(2)
> a: edge length (단위세포의 모서리 길이)
> r = radius (원자 반지름)
( 참고 https://ywpop.tistory.com/12439 )
= (4×197) / sqrt(2)
= 557.2 pm
= 557.2×10^(-10) cm
단위세포의 밀도, density of unit cell
= 질량 / 부피
= (2.66224×10^(-22) g) / (557.2×10^(-10) cm)^3
= (2.66224×10^(-22)) / (557.2×10^(-10))^3
= 1.5389 g/cm3
또는
d = [Z × M] / [a^3 × N_A]
> d: 밀도 (g/cm3)
> Z: 단위세포에 있는 원자의 개수 (개)
> M: 몰질량 (g/mol)
> a: edge length (cm)
> N_A: 6.022×10^23 (개/mol)
= [4 × 40.08] / [(557.2×10^(-10))^3 × (6.022×10^23)]
= 1.5389 g/cm3
답: 1.54 g/cm3
[ 관련 예제 https://ywpop.blogspot.com/2023/09/ag-fcc-144-pm.html ]
은(Ag)의 밀도 계산. 입방 조밀 쌓임 구조 fcc 원자 반지름 144 pm
[키워드] 금속 칼슘의 밀도 기준, 금속 Ca의 밀도 기준, fcc 기준, fcc dic, 고체화학 기준, 고체화학 사전

YOU MIGHT LIKE
모두 보기댓글 쓰기