combustion CH4(g) form H2O(g) CO2(g)
Use Table 9.4 to calculate an approximate heat of reaction
for the combustion of one mole of methane gas (CH4)
to form gaseous H2O and CO2.
What Volume (in L) of methane is needed
to produce 2399 kJ of heat for methane gas
at 40℃ and 7.61 atm pressure?
---------------------------------------------------
CH4 연소 반응식
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
( 참고 https://ywpop.tistory.com/15183 )
ΔH_rxn = Σ[절단 결합의 ΔH_B] – Σ[생성 결합의 ΔH_B]
( 참고 https://ywpop.tistory.com/2559 )
= [4(C–H) + 2(O=O)] – [2(C=O) + 4(O–H)]
= [4(414) + 2(498)] – [2(799) + 4(463)]
= –798 kJ
( 참고: 결합에너지 도표 https://ywpop.tistory.com/2558 )
( 결합에너지는 교재마다 조금씩 다를 수 있다. )
–798 kJ은 CH4 1 mol에 대한 반응열이므로,
–798 kJ / 1 mol = –798 kJ/mol
2399 kJ 생성에 필요한 CH4의 몰수를 계산하면,
2399 kJ / (798 kJ/mol) = 3.0063 mol CH4
PV = nRT 로부터,
( 참고 https://ywpop.tistory.com/3097 )
3.0063 mol CH4의 부피를 계산하면,
V = nRT / P
= (3.0063) (0.08206) (273.15 + 40) / (7.61)
= 10.15 L
답: 10.15 L
[예제] What Volume (in L) of methane is needed
to produce 2343 kJ of heat for methane gas
at 13℃ and 2.50 atm pressure?
2343 kJ / (798 kJ/mol) = 2.93609 mol
V = (2.93609) (0.08206) (273.15 + 13) / (2.50)
= 27.58 L
[키워드] 메탄의 연소엔탈피 기준, 메탄의 반응엔탈피 기준, 결합엔탈피로 반응엔탈피 기준, 결합에너지로 반응엔탈피 기준, CH4 연소엔탈피 기준, CH4 반응엔탈피 기준, ΔH 계산. CH4 + O2

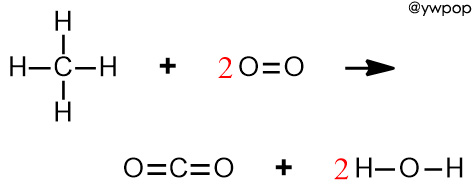
YOU MIGHT LIKE
모두 보기댓글 쓰기