van der Waals. calculate atm 33.52 mol H2 at 160℃ 2.15 L
Use the van der Waals equation to calculate the pressure, in atm,
of 33.52 mol of hydrogen at 160℃ in a 2.15 L container.
Values of van der Waals Constants for Some Common Gases
H2: a = 0.244, b = 0.0266
[참고] 실제기체 방정식. 반데르발스 식
[ https://ywpop.tistory.com/7254 ]
van der Waals equation
P에 대해 정리하면,
> T = 273.15 + 160 = 433.15 K
P = [nRT / (V – nb)] – [n^2 a / V^2]
= [(33.52×0.08206×433.15) / (2.15 – 33.52×0.0266)]
– [((33.52^2)×0.244) / 2.15^2]
= 887.51 atm
답: 887.5 atm
[참고] 이상기체 방정식으로 계산하면,
P = nRT / V
= (33.52) (0.08206) (433.15) / (2.15)
= 554.16 atm
[참고] 이상기체의 압력 < 실제기체의 압력
---> 예상 결과와 다르다.
( 참고 https://ywpop.tistory.com/24577 )
[키워드] van der Waals equation 기준, 실제기체 기준, 실제기체 방정식 기준, 반데르발스 방정식 기준, 반데르발스 식 기준, 반데르발스 기준, 실제기체 사전, 실제기체 방정식 사전, 반데르발스 방정식 사전, 반데르발스 식 사전, 반데르발스 사전

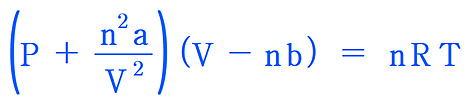

YOU MIGHT LIKE
모두 보기댓글 쓰기