HA(aq) + H2O(l) ⇌ A^-(aq) + H3O^+(aq)
다음 설명 중 가장 옳지 않은 것은?
HA(aq) + H2O(l) ⇌ A^-(aq) + H3O^+(aq)
Ka = 1.8×10^(-5)
1) HA는 약산이다.
2) H2O는 염기로 작용하였다.
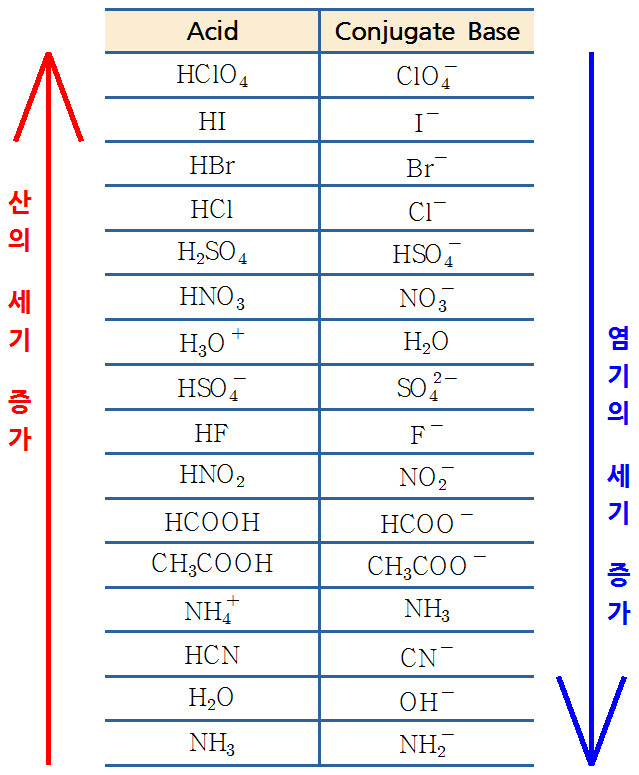
3) 산의 세기는 HA > H3O^+ 이다.
4) A^-는 H2O보다 강한 염기이다.
---------------------------------------------------
3) 산의 세기는 HA > H3O^+ 이다.
HA(aq) + H2O(l) ⇌ A^-(aq) + H3O^+(aq)
이 반응의 Ka = 1.8×10^(-5)
---> HA 산의 세기 척도
A^-(aq) + H3O^+(aq) ⇌ HA(aq) + H2O(l)
이 반응의 Ka = 1 / (1.8×10^(-5)) = 55556
( 참고 https://ywpop.tistory.com/4154 )
---> H3O^+ 산의 세기 척도
Ka 값이 클수록 강산이므로,
( 참고 https://ywpop.tistory.com/4083 )
산의 세기는 H3O^+ > HA 이다.
[참고] 약염기(H2O)의 짝산(H3O^+)은
비교적 강한 산이다.
4) A^-는 H2O보다 강한 염기이다.
약산(HA)의 짝염기(A^-)는 비교적 강한 염기이므로,
A^-는 H2O보다 강한 염기이다.
( 참고 https://ywpop.tistory.com/2937 )
[키워드] 짝산 짝염기 기준

YOU MIGHT LIKE
모두 보기댓글 쓰기