SbF4^- 루이스 구조 그리기
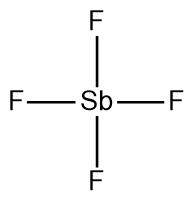
Lewis structure of SbF4^- ion
[참고] 루이스 구조 그리기
[ https://ywpop.tistory.com/6302 ]
[1단계] 각 원자의 원자가전자 수의 합을 구한다.
SbF4^- = (5) + 4(7) + 1 = 34
[2단계] 화합물의 기본 골격 구조를 그린다.
( 단일결합 수만큼 전자 수를 뺀다. )
34 – 4(2) = 26
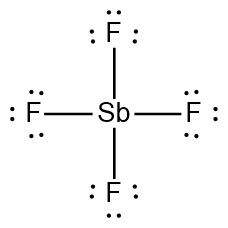
[3단계] 주위 원자들이 팔전자 규칙에 맞도록 전자를 한 쌍씩 그린다.
( 무조건, 그냥 주위 원자 주변에 전자쌍 3개씩 그린다. )
( 그린 전자 수만큼 뺀다. )
26 – 4(6) = 2
[4단계] 중심 원자도 팔전자 규칙에 맞도록 그린다.
2 – 2 = 0
3주기 이상 원소는 최대 18 전자까지 가질 수 있다.
( ∵ 비어있는 d 오비탈을 결합에 사용할 수 있기 때문에 )
---> 확장 팔전자 규칙 또는 18 전자 규칙
( 참고 https://ywpop.tistory.com/3752 )
▶ SbF4^-의 기하구조
> 중심원자 Sb의 전자영역 = 5개
> 전자영역의 기하구조
---> 삼각이중피라미드 기하구조. trigonal bipyramidal.
( 참고 https://ywpop.tistory.com/2571 )
> 비결합전자쌍(lone pair) = 1개 이므로,
SbF4^- 이온의 기하구조
---> 시소형(뒤틀린 사면체) 기하구조. seesaw.
[키워드] SbF4^- 루이스 구조 기준, SbF4^- 루이스 기준



YOU MIGHT LIKE
모두 보기댓글 쓰기