150℃ 1 L 1 mol water atm van der Waals
150℃, 1 L 용기에 들어있는 1 mol 수증기의 압력은
van der Waals 식으로 구하시오.
> a = 5.464 atm dm^6 mol^-2
= 5.464 atm L^2 mol^-2
= 5.464 atm•L^2/mol^2
> b = 3.05×10^(-2) dm^3 mol^-1
= 0.0305 L mol^-1
= 0.0305 L/mol
P = nRT / V
= (1) (0.08206) (273.15 + 150) / (1)
= 34.72 atm
---> 이상기체의 압력
---> 실제기체의 압력은
이 값보다 작은 값이 나와야 할 것이다.
( 참고 https://ywpop.tistory.com/24577 )
실제기체방정식, van der Waals 식
P = [nRT / (V – nb)] – [n^2 a / V^2]
( 참고 https://ywpop.tistory.com/7254 )
= [nRT / (V – nb)] – [n^2 a / V^2]
= [(1) (0.08206) (273.15 + 150) / (1 – (1) (0.0305))]
– [(1^2) (5.464 ) / 1^2]
= 30.35 atm
답: 30.35 atm
[ 관련 예제 https://ywpop.tistory.com/6667 ]
이상기체와 실제기체. 1 L 45 g NH3 기체의 압력
[키워드] 실제기체의 압력 기준

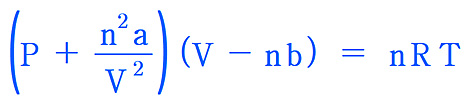
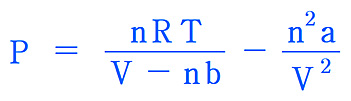
YOU MIGHT LIKE
모두 보기댓글 쓰기