산-염기 중화반응의 화학량론
[참고] 1가 산, 2가 산, 1가 염기, 2가 염기
[ https://ywpop.tistory.com/22918 ]
▶ 1가 산 + 1가 염기 반응
예) HCl + NaOH → NaCl + H2O
---> HCl : NaOH = 1 : 1 로 반응
▶ 2가 산 + 1가 염기 반응
예) H2SO4 + 2NaOH → Na2SO4 + 2H2O
---> H2SO4 : NaOH = 1 : 2 로 반응
▶ 1가 산 + 2가 염기 반응
예) 2HCl + Ca(OH)2 → CaCl2 + 2H2O
---> HCl : Ca(OH)2 = 2 : 1 로 반응
산-염기 중화반응의 본질(알짜 반응)은
산이 이온화되어 내놓는 H^+ 이온과
염기가 이온화되어 내놓는 OH^- 이온의 반응이다.
H^+ + OH^- → H2O
---> H^+ : OH^- = 1 : 1 로 반응
( 참고 https://ywpop.tistory.com/17605 )
HCl + NaOH 반응은
각각 H^+ 이온, OH^- 이온을 1개씩 내놓기 때문에,
HCl : NaOH = 1 : 1 로 반응
H2SO4 + NaOH 반응은
H2SO4가 H^+ 이온을 2개 내놓기 때문에,
OH^- 이온을 1개만 내놓는 NaOH는 2개가 필요.
이 때문에,
H2SO4 : NaOH = 1 : 2 로 반응
HCl + Ca(OH)2 반응은
Ca(OH)2가 OH^- 이온을 2개 내놓기 때문에,
H^+ 이온을 1개만 내놓는 HCl은 2개가 필요.
이 때문에,
HCl : Ca(OH)2 = 2 : 1 로 반응
[키워드] 산-염기 중화반응의 화학량론 기준, 1가 산 기준, 1가 산 사전, 1가 산 2가 산 기준, 1가 산 2가 산 사전

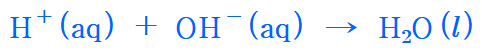
YOU MIGHT LIKE
모두 보기댓글 쓰기