이온 결합 화합물의 이온화 반응식. 일반식
---------------------------------------------------
[참고] 화학식에 나오는 숫자와 괄호의 의미
[ https://ywpop.tistory.com/2968 ]
화학식에 나오는 숫자(아래 첨자)는
숫자 바로 앞 원자의 개수를 나타낸다.
예1) H2O
---> H 원자의 개수 = 2개
---> O 원자의 개수 = 1개 (화학식에서 숫자 1은 생략)
예2) NH3
---> N 원자의 개수 = 1개
---> H 원자의 개수 = 3개
[참고] 이온 결합 화합물 화학식 쓰기
[ https://ywpop.tistory.com/7156 ]
이온 결합 화합물은 전기적으로 중성이므로,
(양이온 개수 × 양이온 전하)
+ (음이온 개수 × 음이온 전하)
= 0 이어야만 한다.
MA → M^+ + A^-
0 = (+1) + (-1)
예) NaCl → Na^+ + Cl^-
M2A → 2M^+ + A^2-
0 = 2(+1) + (-2)
예) Na2S → 2Na^+ + S^-
화학식에서 원자의 개수는
원자의 원소기호 바로 뒤에
아래 첨자인 작은 숫자로 나타내고,
이온화 반응식(= 화학 반응식)에서
이온의 개수는
이온의 원소기호 바로 앞에
일반(보통) 크기의 숫자로 나타낸다.
MA2 → M^2+ + 2A^-
0 = (+2) + 2(-1)
예) CaCl2 → Ca^2+ + 2Cl^-
1개 CaCl2는
1개 Ca^2+ 양이온과
2개 Cl^- 음이온으로 이온화된다.
M3A → 3M^+ + A^3-
0 = 3(+1) + (-3)
예) Li3N → 3Li^+ + N^3-
MA3 → M^3+ + 3A^-
0 = (+3) + 3(-1)
예) AlCl3 → Al^3+ + 3Cl^-
M2A3 → 2M^3+ + 3A^2-
0 = 2(+3) + 3(-2)
예) Al2O3 → 2Al^3+ + 3O^2-
[참고] 이온 전하 값은 어떻게 암기할까?
이온 전하 값은 어떻게 계산할까?
[ 관련 글 https://ywpop.tistory.com/4841 ] 이온 결합 화합물과 원소 주기율표 외우기
[ 관련 글 https://ywpop.tistory.com/9850 ] NaCl의 산화수(이온전하)
[ 관련 글 https://ywpop.blogspot.com/2023/10/alcl3-fecl3.html ] AlCl3의 산화수(이온전하)
[키워드] 화학식의 이해 기준, 화학 반응식의 이해 기준

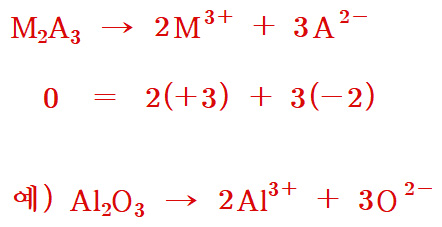
YOU MIGHT LIKE
모두 보기댓글 쓰기