반응속도. 3BrO^-(aq) → BrO3^-(aq) + 2Br^-(aq)
3BrO^-(aq) → BrO3^-(aq) + 2Br^-(aq)
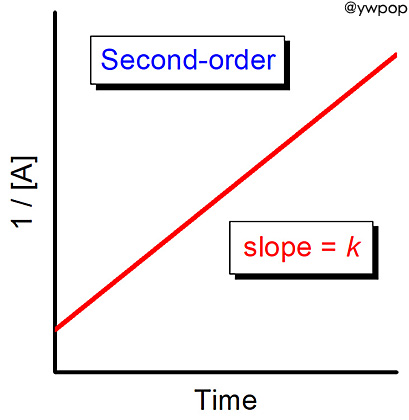
1/[BrO^-]를 시간에 대해서 도시하면
직선의 그래프를 얻고 기울기는 0.056 M-1 s-1이다.
초기 BrO^-의 농도가 0.80 M이라면
절반의 BrO^-가 반응에 참여하는데 걸리는 시간은?
In aqueous solution, hypobromite ion, BrO^-, reacts to produce bromate ion, BrO3^-, and bromide ion, Br^-, according to the following chemical equation.
3BrO^-(aq) → BrO3^-(aq) + 2Br^-(aq)
A plot of 1/[BrO^-] vs. time is linear and the slope is equal to 0.056 M-1 s-1. If the initial concentration of BrO^- is 0.80 M, how long will it take one-half of the BrO^- ion to react?
A) 4.5×10^(-2) s
B) 7.1 s
C) 12 s
D) 22 s
---------------------------------------------------
1/[A] vs. t 그래프가 직선이므로,
---> 2차 반응
( 참고 https://ywpop.tistory.com/22244 )
기울기 = k = 0.056 M-1 s-1
---> 속도 상수
[참고] 속도 상수의 단위가 M-1 s-1
---> 2차 반응
절반의 BrO^-가 반응에 참여하는데 걸리는 시간
= 반감기
2차 반응의 반감기
t_1/2 = 1 / (k [A]_0)
= 1 / ((0.056 M-1 s-1) (0.80 M))
= 1 / ((0.056) (0.80))
= 22.3 s
답: D) 22 s
[키워드] 2차 반응 기준, 반응 속도론 기준

YOU MIGHT LIKE
모두 보기댓글 쓰기