Cu의 밀도. 0.128 nm 1.28 Å FCC 63.5 g/mol
Cu는 0.128 nm (1.28 Å)의 반지름과
FCC 결정구조를 가지며,
원자량을 63.5 g/mol이다.
밀도를 계산하시오.
Copper has an atomic radius of 0.128 nm, a FCC crystal structure, and an atomic weight of 63.5 g/mol. What is its theoretical density?
Copper has an FCC crystal structure and an atomic radius of 0.128 nm. Calculate the theoretical density of copper if the atomic mass of Cu is 63.5 g/mol.
(0.128 nm) (1 m / 10^9 nm) (100 cm / 1 m)
= (0.128) (1 / 10^9) (100)
= 1.28×10^(-8) cm = r
[그림] FCC crystal structure.
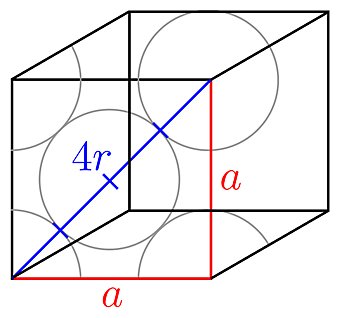
4r = a × √2 이므로,
a = 4r / √2
= (4×1.28×10^(-8)) / √2
= 3.62×10^(-8) cm
FCC crystal structure
---> Z = 4
( 참고 https://ywpop.tistory.com/12440 )
d = [M × Z] / [N_A × a^3]
( 참고 https://ywpop.tistory.com/12439 )
= [63.5 × 4] / [(6.022×10^23) × (3.62×10^(-8))^3]
= 8.89 g/cm3
답: 8.89 g/cm3
[키워드] 고체화학 기준, 금속의 밀도 기준, 구리의 밀도 기준, 고체화학 사전, 금속의 밀도 사전, 구리의 밀도 사전, copper Cu 0.128 nm FCC 63.5 g/mol density

YOU MIGHT LIKE
모두 보기댓글 쓰기