수소 원자와 다전자 원자의 에너지 준위가 다른 이유
Why energy level of orbitals is different for hydrogen and other multi-electron atoms?
[참고] 오비탈의 축퇴, degenerate orbital
[ https://ywpop.tistory.com/2919 ]
[참고] 다전자 원자 오비탈의 에너지 준위
[ https://ywpop.tistory.com/6813 ]
▶ 수소 원자는 전자가 딱 1개뿐이다.
---> 전자 간 반발이 없다.
---> 수소 원자의 에너지 준위는
오로지 주양자수(n)에 의해 결정된다.
▶ 다전자 원자는 전자가 2개 이상 존재한다.
---> 전자 간 반발이 존재한다.
---> 다전자 원자의 에너지 준위는
주양자수(n)와 각운동량 양자수(l)에 의해 결정된다.
( 참고: (n+l) 규칙 https://ywpop.tistory.com/2841 )
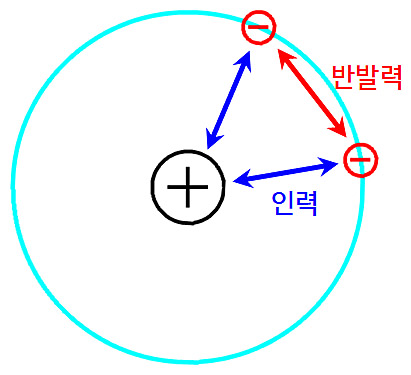
[그림] 다전자 원자에서 전자에 작용하는 힘. 인력과 반발력.
수소 원자에서는 그림과 같은 전자 간 반발력이 존재하지 않는다.
이 차이 때문에,
수소 원자와 다전자 원자의 에너지 준위가 다르다.
[ 관련 글 https://ywpop.tistory.com/9247 ]
수소 원자의 오비탈 에너지 준위는 오로지 주양자수에 의해서만 결정되는 이유
[ 관련 글 https://ywpop.tistory.com/9565 ] 수소 원자는 별난 녀석
[키워드] 수소 원자의 에너지 준위 기준, 수소 원자의 에너지 준위 사전, 수소 원자 오비탈의 에너지 준위 기준, 수소 원자 오비탈의 에너지 준위 사전, 다전자 원자의 에너지 준위 기준, 다전자 원자의 에너지 준위 사전, 다전자 원자 오비탈의 에너지 준위 기준, 다전자 원자 오비탈의 에너지 준위 사전

YOU MIGHT LIKE
모두 보기댓글 쓰기