HCl은 루이스 산, NH3는 루이스 염기
HCl as a Lewis acid, NH3 as a Lewis base
[참고] 산-염기의 정의. 산-염기의 종류
[ https://ywpop.tistory.com/2696 ]
Q. There isn’t an empty orbital anywhere on the HCl
which can accept a pair of electrons.
Why, then, is the HCl a Lewis acid?
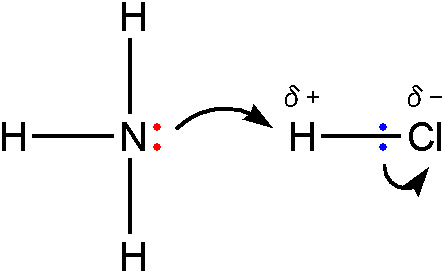
The lone pair on the nitrogen of an ammonia molecule
is attracted to the slightly positive hydrogen atom in the HCl.
As it approaches it, the electrons in the hydrogen-chlorine bond
are repelled still further towards the chlorine.
Eventually, a coordinate bond is formed
between the nitrogen and the hydrogen,
and the chlorine breaks away as a chloride ion.
This is best shown using the “curly arrow” notation
commonly used in organic reaction mechanisms.
NH3(g) + HCl(g) → NH4^+(s) + Cl^-(s)
The whole HCl molecule is acting as a Lewis acid.
It is accepting a pair of electrons from the ammonia,
and in the process it breaks up.
Lewis acids don’t necessarily have to have an existing empty orbital.
루이스 산이 되려면, 즉 루이스 산은
전자쌍을 받을 수 있는 비어있는 오비탈이 있어야 됩니다.
단, 필수 조건은 아닙니다.
정리하면, HCl은, 비록, 비어있는 오비탈은 없지만,
루이스 염기인 NH3의 전자쌍을 통해(받아들임으로써) 반응했으므로,
HCl은 루이스 산에 해당된다고 설명하고 있습니다.
[ 출처 https://chem.libretexts.org ]
모든 브뢴스테드-로우리 산은 루이스 산입니다.
단, 모든 루이스 산은 브뢴스테드-로우리 산이 아닙니다.
All Brønsted-Lowry acids are Lewis acids,
but the reverse is not true.
모든 아레니우스 산은 브뢴스테드-로우리 산이며,
모든 브뢴스테드-로우리 산은 루이스 산입니다.
Just as any Arrhenius acid is also a Brønsted acid,
any Brønsted acid is also a Lewis acid.
All Brønsted-Lowry bases are Lewis base
but all Lewis bases are not Bronsted-Lowry base.
All Arrhenius acids and bases are Brønsted-Lowry acids and bases as well.
But not all Brønsted-Lowry acids and bases are Arrhenius acids and bases.
[ 관련 글 https://ywpop.tistory.com/8311 ] H2O는 루이스 산
[키워드] HCl은 루이스 산 기준, 염산은 루이스 산 기준, 루이스 산 기준, NH3 + H^+ → NH4^+, NH4^+ 그림 기준


YOU MIGHT LIKE
모두 보기댓글 쓰기