BF3 루이스 NH3 루이스. 기하구조
[참고] 전자영역 또는 입체수(steric number)와
비결합전자쌍 수에 따른 분자의 기하구조
[ https://ywpop.tistory.com/2571 ]
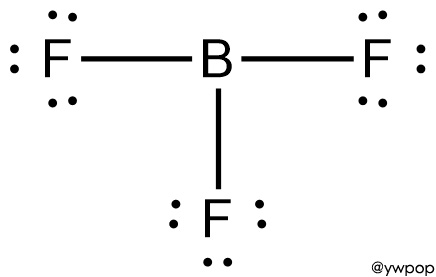
[그림] Lewis structure of BF3.
( 참고 https://ywpop.tistory.com/11234 )
> 중심 원자 B의 전자 영역 = 3개
---> 3개 모두 결합 전자쌍
---> 기하 구조: 삼각 평면
[그림] Lewis structure of NH3.
( 참고 https://ywpop.tistory.com/22392 )
> 중심 원자 N의 전자 영역 = 4개
---> 3개는 결합 전자쌍, 1개는 비결합 전자쌍
---> 기하 구조: 삼각뿔 (trigonal pyramid)
[그림] BF3–NH3 루이스 구조.
( 참고 https://ywpop.tistory.com/6023 )
> B, N, 각각의 전자 영역 = 4개
---> 4개 모두 결합 전자쌍
---> B, N, 각각의 기하 구조: 정사면체
[그림] BF3–NH3 3D 볼 앤 스틱 모델.
[ 관련 글 https://ywpop.tistory.com/15198 ] BCl3와 NH3의 분자구조가 다른 까닭
[키워드] BF3 루이스 기준, NH3 루이스 기준, NH3BF3 기준, NH3BH3 기준, NH3-BF3 기준, NH3-BH3 기준, BF3NH3 기준, BH3NH3 기준, BF3-NH3 기준, BH3-NH3 기준




YOU MIGHT LIKE
모두 보기댓글 쓰기